a'tom (græsk): den mindste del, hvori et stof kan deles, når dets egenskaber skal bevares. Kan godt spaltes i mindre dele, elementarpartikler, der imidlertid ikke er grundstoffer. Består af en kerne, atomkernen, der er sammensat af positivt ladede protoner og neutrale neutroner (med fællesbetegnelsen nukleoner), som holdes sammen af specielle kernekræfter og er omgivet af skaller af negativt ladede elektroner. Elektroner og protoner har lige store ladninger, og der er normalt lige mange af dem. Deres, ikke sammenlagte, tal kaldes atomnummeret og er karakteristisk for det pågældende grundstof. Når der er lige mange af dem, fremtræder atomet neutralt. Atomets vægt udgøres væsentligst af protoner og neutroner, der vejer omtrent det samme, med mindre bidrag fra bindingsenergi og elektroner. Elektronskallerne er bestemmende for stoffernes kemiske og mange af deres fysiske egenskaber. Ved fraspaltning eller optagelse af elektroner bliver atomerne ladede ioner; elektronerne kan binde flere atomer sammen til et molekyle, og, når varmebevægelsen er tilstrækkelig lille, til væsker og krystaller. Elektronskallerne kan beskrives som værende i visse tilstande med veldefineret energi; ved udstråling af lys, røntgenstråler osv. og absorption af stråling sker der overgang mellem tilstandene under bevarelse af den samlede energi. Et stabilt system som atom, molekyle osv. har en grundtilstand, hvorfra der ikke kan udstråles yderligere energi; de højere tilstande kaldes anslåede. I naturen forekommer 88 forskellige grundstoffer, men man kan fremstille ca. 15 andre, de såkaldte transuraner. Atomer, som indbyrdes har samme atomnummer, men som på grund af af forskelligt neutrontal har forskellig atomvægt, kaldes isotoper af samme grundstof. Det letteste atom er brintatomet, hvis kerne for den hyppigst forekommende isotops vedkommende består af 1 proton. Atomernes masse ligger mellem 1,5 x 10-24 og 450 x 10-24 g, deres diametre mellem 10-8 og 10-7 cm, dvs. at der går ca. 10 mill. på en mm. Virkningerne af enkelte atomer eller elementarpartikler kan iagttages fx i Geiger-Müller-tælleren; deres bane kan ses i Wilsonkammeret m.m. Stoffernes opbygning af atomer ses ved røntgenstrålers bøjning og i feltemissionsmikroskop.
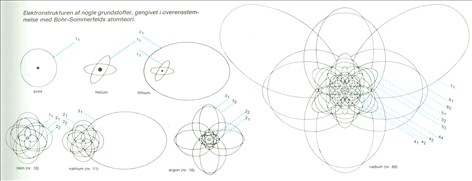
Elektronstrukturen af nogle grundstoffer, gengivet i overensstemmelse med Bohr-Sommerfelds atomteori.

Øverst tv. Forskellige betegnelser, som anvendes i forbindelse med angivelse af elektroners tilstand, pA figuren vist for den inaktive luftart neon. K og L er betegnelser for elektronskallerne, og med S og P betegnes elektronskyens form. n kaldes hovedkvantetallet, og bikvantetallet I angiver, hvilket underniveau elektronen tilhører.
Opbygningen af de første 9 grundstoffer i Det periodiske System er vist nedenfor, idet atomkernen er violet, elektroner; K-skallen røde og elektroner i L-skallen blå. 1) Brint. 2) Helium. 3) Uthium. 4) Beryllium. 5) Bor. 6) Kulstof. 7) Kvælstof. 8) Ilt. 9) Fluor.

Manipulator, ved hjælp af hvilken operatøren kan arbejde med radioaktivt materiale uden at blive udsat for farlig stråling.
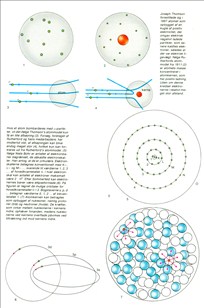
Øverst: Joseph Thomson forestillede sig ; 1897 atomet som opbygget af en kugle af positiv elektricitet, der omgav elektrisk negativt ladede partikler, som senere kaldtes elektroner, således at der var elektrisk ligevægt. Ifølge Rutherfords atommodel fra 1911(2) er atomets masse koncentreret i atomkernen, som har positiv ladning. Uden om denne kredser elektronerne i relativt meget stor afstand.
Derunder: Hvis et atom bombarderes med a-partikler, vil det ifølge Thomson's atommodel kun M en lille afbøjning (3). Forsøg, foretaget af Rutherford og hans medarbejdere, har imidlertid vist, af afbøjningen kan blive endog meget stor (4), hvilket kun kan forklares ud fra Rutherford's atommodel. (5) Ifølge Niels Bohr er antallet af elektronbaner begrænset, de såkaldte elektronskalter. Han antog, at de er cirkulære. Elektronskallerne betegnes konventionelt med K-, Log M.... svarende til værdierne 1,2,3 .... af hovedkvantetallet n. I hver elektronskai kan antallet af elektroner maksimalt være 2 . 02. Eher Sommerfeld kan etearonernes baner være ellipseformede (6). På figuren er tegnet de mulige orbitaler for hovedkvantetallet n=3. Bogstaverne s, p, d ... betegner værdierne O, 1, 2 ... af bikvan· tetallet 1. (7) Atomkernen kan betragtes som opbygget af nukleoner, nemlig protoner (blå) og neutroner (hvide). De kræfter, som virker mellem nukleonerne i kernens indre, ophæver hinanden, medens nukteoneme ved kernens overflade påvirkes ved tiltrækning ind mod kernens indre.
.............................................................................................................